Gorivna celica je elektrokemična naprava, ki uporablja gorivo in oksidant (ponavadi vodik in kisik) za proizvodnjo elektrike. Čeprav gorivna celica deluje podobno kot baterija, se ne izprazni in ne potrebuje vnovičnih polnenj. Ker poteka pretvorba goriva v energijo v obliki elektrokemičnega procesa in ne izgorevanja, je gorivna celica tišja in čistejša kot bencinski ali dizelski generator.
Možnih je več kombinacij goriv in oksidantov. Vodikova gorivna celica uporablja vodik kot gorivo in kisik (ponavadi iz zraka) kot svoj oksidant. Druga možna goriva so ogljikovodiki in alkoholi. Drugi možni oksidanti vključujejo klor in klorov dioksid.
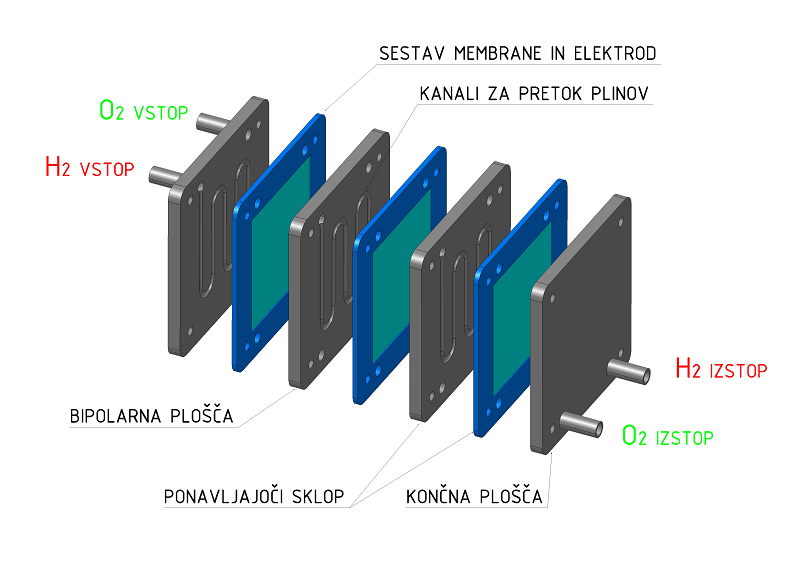
Gorivne celice s protonsko izmenjevalno membrano (PEM) delujejo pri relativno nizkih temperaturah, nudijo hiter zagon in kot gorivo za delovanje potrebujejo le vodik, in kisik iz zraka. Jedro sistema gorivne celice je sklad, sestavljen iz bipolarnih plošč (z pretočnimi polji za reaktante), ki so zložene poleg membransko-elektrodnih sklopov (MEA), le-te pa sestojijo iz elektrolita (membrane) in dveh poroznih elektrod (anoda in katoda), ki sta prevlečeni s katalizatorjem. Sistemi gorivnih celic ponavadi vsebujejo tudi nekaj črpalk, ventilov, elektronike in drugih specifičnih komponent (potrebnih za ravnotežje sistema) vključno z dovodom goriv, hlajenjem in energetskim upravljanjem.
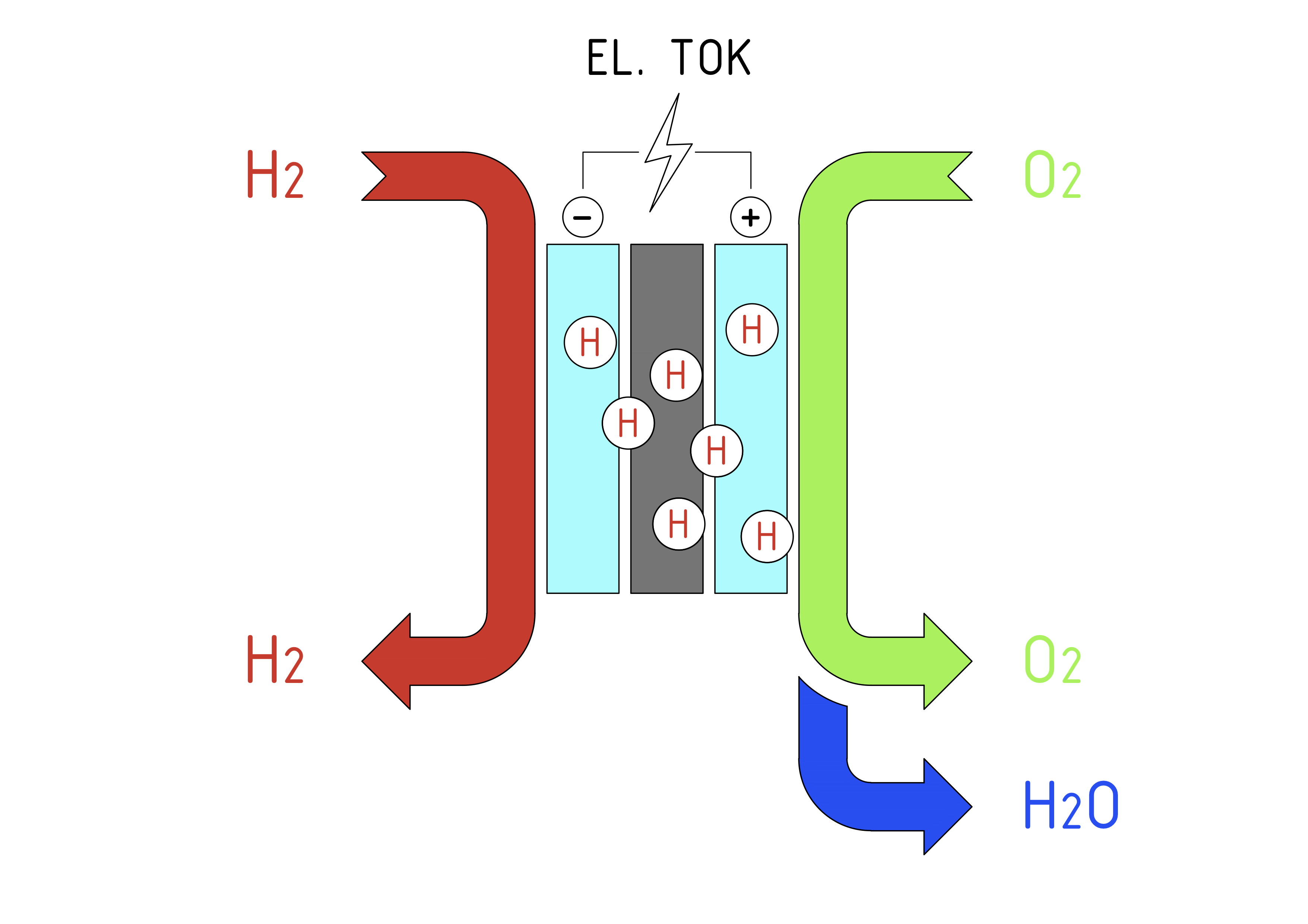
V sistemu gorivnih celic se na anodno stran sklada dovaja vodik, kjer (platinski) katalizator loči vodikove negativno nabite elektrone od pozitivno nabitih protonov. Vodikovi protoni se nato premaknejo skozi membrano na katodno stran in se združijo s kisikom iz zraka in elektroni, kjer se proizvede tolpota in voda. Elektroni na anodni strani ne morejo prehajati skozi membrano in so posledično primorani potovati po zunanjem tokokrogu, da dospejo na katodno stran celice. Nastali tok elektronov je uporaben kot električni tok.
Območje delovanja HTPEM sistemov se začne pri temperaturah nad 120°C, večina jih deluje nad 150°C, nekateri pa preizkušeno normalno delujejo tudi pri temperaturah do 210°C. Prednosti tako povišane delovne temperature so v precej povečani toleranci do nečistoč, ki so prisotne v gorivu, kot na primer prisotnost CO v H2, in hkrati tudi dobrodejno vpliva na samo učinkovitost gorivne celice, saj povišanje temperature povzroči tudi višjo kinetično stopnjo elektrod.
Višja delovna temperatura tudi v veliki meri zmanjša potrebo po upravljanju z vodo v sistemu, saj je vsa prisotna voda uparjena. Tako se prepreči možnost 'zalitja' in hkrati zmanjša potrebno odvajanje toplote iz sistema, kar posledično pomeni tudi manj ali manjše hladilnike oz. izmenjevalce toplote pri zasnovi sistema. Ker večina HTPEM membran ni osnovanih na vodi, potemtakem tudi ni potrebno vlažiti sistema, kar še dodatno zmanjša ceno in kompleksnost samega sistema.
Gorivna celica na trdne okside je elektro-kemična konverzijska naprava, ki proizvaja elektriko neposredno iz goriva. V SOFC gorivni celici se uporablja keramičen material kot elektrolit in celica deluje pri temperaturah med 650 in 1000°C. Zasnova sistema poskrbi za to, da uporabnik čuti le hladne zunanje površine.
V gorivni celici na trdne okside prehajajo kisikovi protoni skozi elektrolit, za razliko od PEM gorivnih celic, kjer prehajajo vodikovi protoni skozi membrano. To pomeni, da se lahko kot gorivo uporablja tudi druge snovi in ne samo vodik. SOFC dobro delujejo tudi z vodikom in mešanicami vodika in ogljikovega monoksida. Z vgradnjo zelo preprostega reformerja v sistem bi lahko proizvajali mešanice vodika in ogljikovega monoksida iz naslednjih široko dostopnih goriv:
Vodik je najlažji in najpogostejši element in predstavlja približno 75% kemične elementarne mase našega vesolja. Vodik se na Zemlji zelo redko pojavlja v svoji elementarni obliki. Pri normalni temperaturi in pritisku je vodik brezbarven, brez vonja, nekovinski, brez okusa, zelo vnetljiv dvoatomski plin z molekularno formulo H2.
Industrijska proizvodnja poteka v glavnem s parnim reformingom zemeljskega plina, redkeje pa tudi z bolj energetsko intenzivnimi metodami kot je elektroliza vode. Večina vodika se porabi blizu kraja proizvodnje; največja porabnika vodika pa sta predelava fosilnih goriv (hydro cracking) in proizvodnja amonijaka za potrebe kmetijskega trga.
Metanol je ogljikovodik, sestavljen iz ogljika, vodika in kisika, njegova kemična formula pa je CH3OH. Metanol je poznan tudi kot lesni alkohol, saj je bil nekoč proizvajan v glavnem z destilacijo lesa. Dandanes se največ metanola pridobi iz metanskih komponent zemeljskega plina. Lahko ga tudi proizvajamo iz organskih materialov in nastali organski metanol, ali bio-alkohol, je obnovljiva alternativa fosilnim ogljikovodikom.
Metanol je pri sobni temperaturi v tekočem stanju in ga je veliko lažje premikati in shranjevati kot vodik, zaradi česar je zelo praktičen. Metanol lahko vodimo skozi postopek reforminga, da bi pridobili vodik, ki ga nato direktno vodimo v gorivno celico za proizvodnjo električne energije. Stranska proizvoda reforminga sta malo vode (H2O) in ogljikov dioksid (CO2).